Inhoud
- Wat zijn vetten?
- Structuur van vetten
- Koolwaterstoffen en micellen
- Verzadigde versus onverzadigde vetten
Vetten zijn gemaakt van triglyceriden en zijn in het algemeen oplosbaar in organische oplosmiddelen en zijn onoplosbaar in water. Koolwaterstofketens in triglyceriden bepalen de structuur en functionaliteit van vetten. De waterbestendigheid van de koolwaterstoffen maakt ze onoplosbaar in water en helpt ook bij de vorming van micellen, sferische vetformaties in waterige oplossingen. Koolwaterstoffen spelen ook een rol in de smeltpunten van vet door verzadiging, of het aantal dubbele bindingen dat aanwezig is tussen de koolstofatomen van koolwaterstoffen.
Wat zijn vetten?
Vetten vallen onder de categorie lipiden die in het algemeen oplosbaar zijn in organische oplosmiddelen en onoplosbaar zijn in water. Vetten kunnen vloeibaar zijn, zoals olie, of vast, zoals boter, bij kamertemperatuur. Het verschil tussen olie en boter is te wijten aan de verzadiging van vetzuurstaarten. Wat vetten onderscheidt van andere lipiden is de chemische structuur en fysische eigenschappen. Vetten dienen als een belangrijke bron van energieopslag en isolatie.
Structuur van vetten
••• Ryan McVay / Lifesize / Getty ImagesVetten bestaan uit triesters van glycerol gehecht aan vetzuurstaarten gemaakt van koolwaterstoffen. Omdat er voor elke glycerol drie vetzuren zijn, worden vetten vaak triglyceriden genoemd. De koolwaterstofketen die vetzuren vormt, maakt het uiteinde van het molecuul hydrofoob of waterbestendig, terwijl de glycerolkop hydrofiel of 'waterminnend' is. Deze eigenschappen hebben te maken met de polariteit van de moleculen waaruit elke zijde bestaat.De hydrofobiciteit is te wijten aan de niet-polaire eigenschappen van de koolstof-koolstof- en koolstof-waterstofbindingen in koolwaterstofketens. Het hydrofiele kenmerk van glycerol is te wijten aan de hydroxylgroepen, die het molecuul polair maken en gemakkelijk mengen met andere polaire moleculen, zoals water.
Koolwaterstoffen en micellen


Een van de ongebruikelijke eigenschappen van vetten is het vermogen om te emulgeren. Emulsificatie is het belangrijkste concept achter zeep, dat kan interageren met zowel polair water als niet-polaire vuildeeltjes. De polaire kop van het vetzuur interageert met het water en de niet-polaire staarten kunnen interageren met vuil. Deze emulgering kan micellen vormen - ballen van vetzuren - waarbij de poolkoppen de buitenlaag vormen en de hydrofobe staarten de binnenlaag vormen. Zonder koolwaterstoffen zouden micellen niet mogelijk zijn, omdat de hydrofobiciteitsdrempel van kritische micelconcentratie of cmc een belangrijke rol speelt bij de vorming van micellen. Nadat de hydrofobiciteit van koolwaterstoffen een bepaald punt in een polair oplosmiddel bereikt, bundelen de koolwaterstoffen automatisch samen. De polaire koppen drukken naar buiten om te interageren met het polaire oplosmiddel en alle polaire moleculen worden uitgesloten van het inwendige volume van de micel omdat niet-polaire vuildeeltjes en koolwaterstoffen de binnenruimte vullen.
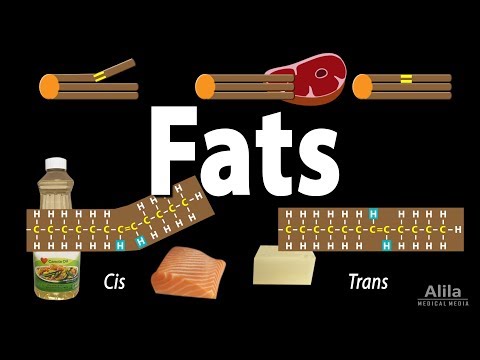
Verzadigde versus onverzadigde vetten
Verzadiging verwijst naar het aantal dubbele bindingen dat aanwezig is in de koolwaterstofstaart. Sommige vetten hebben geen dubbele bindingen en hebben het maximale aantal waterstofatomen gehecht aan de koolwaterstofstaart. Deze vetzuren, ook bekend als verzadigde vetten, hebben een rechte structuur en zijn stevig samengepakt om bij kamertemperatuur een vaste stof te vormen. Verzadiging bepaalt ook de fysieke toestand en smeltpunten van de vetzuren. Terwijl verzadigde vetten bijvoorbeeld vaste stoffen zijn, vanwege hun structuur bij kamertemperatuur, hebben onverzadigde vetten, zoals oliën, in hun koolwaterstofstaarten krommingen door dubbele binding in hun koolstof-koolstofbindingen. De bochten zorgen ervoor dat de oliën vloeistoffen of halfvaste stoffen zijn bij kamertemperatuur. Daarom hebben verzadigde vetten hogere smeltpunten vanwege de rechte structuur van hun koolwaterstofstaarten. Dubbele bindingen in onverzadigde vetten maken ze gemakkelijker af te breken bij lagere temperaturen.