
Inhoud
- TL; DR (te lang; niet gelezen)
- Hoe mollen te berekenen
- Omzetten naar Mmol
- Oplossingsconcentratie
- Voorbeeld
Om eenvoudig hun berekeningen te maken, creëerden chemici een standaardeenheid voor het aantal atomen van een bepaalde verbinding die bij een reactie of een ander chemisch proces betrokken was. Ze definiëren één mol (mol) als de hoeveelheid van een stof die hetzelfde aantal fundamentele eenheden heeft als 12 gram koolstof-12, dat is het Avogadros-getal (6.022 × 1023). Het SI (metrische) meetsysteem definieert een millimol (Mmol) als een duizendste van een mol. Over het algemeen berekent u het aantal mol van een stof door de hoeveelheid die u bij de hand hebt te wegen. Als je wilt converteren naar Mmol, vermenigvuldig met 103 (1,000).
TL; DR (te lang; niet gelezen)
Eén mol is gelijk aan het Avogadros-aantal deeltjes van een bepaalde verbinding. Een millimol (Mmol) is een duizendste mol.
Hoe mollen te berekenen
Atoommassa's worden gemeten in atomaire massa-eenheden (AMU). Eén AMU is precies 1/12 van de massa van een kern van een koolstof-12-atoom in zijn grondtoestand. Een mol van een stof is gedefinieerd als gelijk aan het Avogadros-aantal deeltjes van die stof. Volgens deze definitie is het gewicht van één mol van een stof in grammen hetzelfde aantal als het gewicht van een afzonderlijk deeltje van die stof in AMU. Het atoomgewicht van koolstof-12 is bijvoorbeeld 12 AMU, dus een mol koolstof-12 weegt 12 gram.
Overweeg een container vol waterstofgas (H2). Elk deeltje in de container is een molecuul dat bestaat uit twee waterstofatomen, dus u hoeft alleen de atoommassa van waterstof te kennen om het molecuulgewicht te berekenen. De meeste versies van het periodiek systeem vermelden de atoommassa van elk element onder het symbool. Voor waterstof, dat een enkel proton in zijn kern heeft, is zijn 1.008 AMU, wat een gemiddelde is van alle natuurlijk voorkomende isotopen van waterstof. Bijgevolg is de atoommassa van waterstofgas 2,016 AMU en weegt een mol waterstofgas 2,016 gram. Om het aantal mol in uw monster te vinden, zou u het monster in gram wegen en dat gewicht delen door het molecuulgewicht van waterstofgas in gram. Een monster met een gewicht van 15 gram zuiver waterstofgas bevat bijvoorbeeld 7,44 mol.
Omzetten naar Mmol
Soms zijn de onderzochte hoeveelheden zo klein dat het lastig is ze in mollen uit te drukken. Voer de millimole in. Door het aantal mol te vermenigvuldigen met duizend, kunt u een heel klein aantal omzetten in een beter beheersbaar aantal. Dit is met name handig bij volume-eenheden in de orde van milliliter.
1 mol = 1.000 Mmol
Oplossingsconcentratie
Chemici gebruiken molariteit als een maat voor de concentratie van een bepaalde verbinding in oplossing. Ze definiëren molariteit als het aantal mol per liter. U converteert molariteit naar millimolariteit door te vermenigvuldigen met 1.000. Een oplossing van 1 mol (molair, ook geschreven als M) heeft bijvoorbeeld een concentratie van 1 mol per liter. Dit komt overeen met een oplossing van 1.000 Mmol (millimolair, soms ook geschreven als mM), een oplossing die 1.000 Mmol per liter bevat.
Voorbeeld
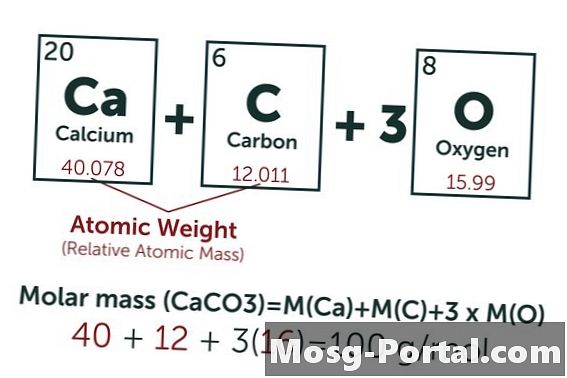
Een oplossing bevat 0,15 gram calciumcarbonaat. Hoeveel millimol is dat?
De chemische formule van calciumcarbonaat is CaCO3. Het atoomgewicht van koolstof (C) is ongeveer 12 AMU, dat van zuurstof (O) ongeveer 16 AMU en dat van calcium (Ca) ongeveer 40 AMU. Elk molecuul calciumcarbonaat weegt dus 100 AMU, wat betekent dat een mol ongeveer 100 gram weegt. Een gewicht van 0,15 gram vertegenwoordigt 0,15 g - 100 g / mol = 0,0015 mol. Dit komt overeen met 1,5 Mmol.
Wat is de molariteit en millimolariteit van zoveel calciumcarbonaat in 2,5 liter oplossing?
Molariteit wordt gedefinieerd als het aantal mol per liter, dus deel het aantal mol door 2,5 om de molariteit te krijgen: 0,0015 ÷ 2,5 =
0,0006 M
Vermenigvuldig met 1.000 om de millimolariteit = te krijgen
0,6 mM
Merk op dat u hetzelfde resultaat krijgt voor millimolariteit als u het aantal millimol deelt door het volume van de oplossing.