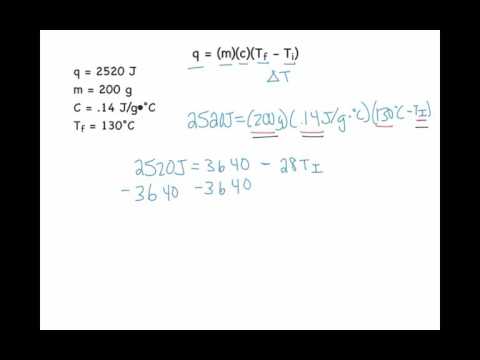
Inhoud
- TL; DR (te lang; niet gelezen)
- Vergelijking voor specifieke warmte
- Specifieke warmte gebruiken om de begintemperatuur te vinden
- Specifieke warmte- en faseveranderingen
Wat kost meer energie om op te warmen: lucht of water? Hoe zit het met water versus metaal of water versus een andere vloeistof zoals frisdrank?
Deze vragen en vele andere hebben betrekking op een eigenschap van materie die specifieke warmte wordt genoemd. Specifieke warmte is de hoeveelheid warmte per massa-eenheid die nodig is om de temperatuur van een stof met één graad Celsius te verhogen.
Het kost dus meer energie om water op te warmen dan lucht, omdat water en lucht verschillende specifieke verwarmingen hebben.
TL; DR (te lang; niet gelezen)
Gebruik de formule:
Q = mcAT, ook geschreven Q = mc (T - t0)
om de begintemperatuur te vinden (t0) in een specifiek warmteprobleem.
Water heeft zelfs een van de hoogste specifieke temperaturen van elke "gewone" stof: de 4.186 joule / gram ° C. Daarom is water zo nuttig bij het matigen van de temperatuur van machines, menselijke lichamen en zelfs de planeet.
Vergelijking voor specifieke warmte
U kunt de eigenschap van specifieke warmte gebruiken om de begintemperatuur van een stof te bepalen. De vergelijking voor specifieke warmte wordt meestal geschreven:
Q = mcAT
waarbij Q de hoeveelheid toegevoegde warmte-energie is, m de massa van de stoffen is, c specifieke warmte is, een constante, en AT betekent "temperatuurverandering".
Zorg ervoor dat uw meeteenheden overeenkomen met de eenheden die worden gebruikt in de specifieke warmteconstante! Soms kan de specifieke warmte bijvoorbeeld Celsius gebruiken. Andere keren krijg je de SI-eenheid voor temperatuur, dat is Kelvin. In deze gevallen zijn de eenheden voor specifieke warmte Joule / gram ° C of anders Joule / gram K. Hetzelfde kan gebeuren met gram versus kilogram voor de massa, of Joule tot Bmu voor energie. Controleer de eenheden en voer de benodigde conversies uit voordat u aan de slag gaat.
Specifieke warmte gebruiken om de begintemperatuur te vinden
ΔT kan ook worden geschreven (T - t0), of een nieuwe temperatuur van een stof minus de begintemperatuur. Dus een andere manier om de vergelijking voor specifieke warmte te schrijven is:
Q = mc (T - t0)
Dus deze herschreven vorm van de vergelijking maakt het eenvoudig om de begintemperatuur te vinden. Je kunt alle andere waarden die je krijgt inpluggen en vervolgens oplossen voor t0.
Bijvoorbeeld: Stel dat u 75,0 joule energie toevoegt aan 2,0 gram water, waardoor de temperatuur stijgt naar 87 ° C. Waterspecifieke warmte is 4.184 Joule / gram ° C. Wat was de begintemperatuur van het water?
Steek de gegeven waarden in uw vergelijking:
75.o J = 2,0 g x (4.184 J / g ° C) x (87 ° C - t0).
Makkelijker maken:
75.o J = 8.368 J / ° C x (87 ° C - t0).
8,96 ° C = (87 ° C - t0)
78 ° C = t0.
Specifieke warmte- en faseveranderingen
Er is een belangrijke uitzondering om in gedachten te houden. De specifieke warmtevergelijking werkt niet tijdens een faseverandering, bijvoorbeeld van een vloeistof naar een gas of een vaste stof naar een vloeistof. Dat komt omdat alle extra energie die wordt gepompt wordt gebruikt voor de faseverandering, niet voor het verhogen van de temperatuur. Dus de temperatuur blijft gedurende die periode vlak, waardoor de relatie tussen energie, temperatuur en soortelijke warmte in die situatie wordt weggegooid.