Een beschrijving van de structuur van het atoom omvat besprekingen van de kern van het atoom en besprekingen van de elektronenorbitalen van het atoom. In eenvoudige bewoordingen zijn de elektronenorbitalen concentrische bollen rond de kern waar elektronen verblijven, waarbij elke bol wordt geassocieerd met een bepaalde energiewaarde. Hoe dichter de elektronenbol zich bij de kern bevindt, hoe lager de energie die de elektronen in die bol bezitten. Twee hoofdtypen van orbitalen nemen deel aan de binding van atomen. Deze orbitalen zijn degenen die de valentie-elektronen vasthouden. De s- en p-orbitalen nemen deel aan de binding van atomen met elkaar in covalente bindingen. Terwijl je naar beneden beweegt in het periodiek systeem, voegt elke rij elementen een ander type orbitaal toe dat beschikbaar is voor de elektronen van het atoom. De elektronen van het atoom vullen de orbitalen van de laagste energie-orbitalen tot de hoogste energie-orbitalen en elke baan bevat twee elektronen. Wanneer twee elektronen orbitalen bezetten, hebben ze een hogere energie dan orbitalen die slechts één elektron bevatten.
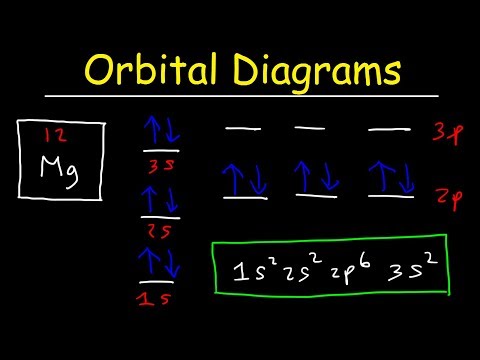
Bepaal het aantal elektronen in het betreffende atoom. Het aantal elektronen in het atoom is gelijk aan het atoomnummer van het element.
Schrijf de elektronenconfiguratie voor het betreffende element. Vul de orbitalen van het atoom in de volgorde 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p en 5s. Elke s orbitaal kan twee elektronen bevatten, elke p orbitaal kan zes elektronen bevatten en elke d orbitaal kan 10 elektronen bevatten.
Onderscheid welke s of p orbitaal het laatst is gevuld. Deze orbitalen bevatten de valentie-elektronen voor het element. Zoek bijvoorbeeld de volantorbit van silicium. Silicium is element nummer 14 en heeft dus 14 elektronen. De beschikbare orbitalen voor silicium zijn 1s, 2s, 2p, 3s en 3p. De elektronen vullen de 1s, 2s, 2p en 3s orbitalen en plaatsen de laatste twee elektronen in de 3p orbitalen. Silicium heeft vier volant-elektronen. Twee komen uit de 3s orbitaal en 2 komen uit de 3p orbitalen.