Inhoud
- Paramagnetische versus diamagnetische elementen
- Berekenen of een element paramagnetisch of diamagnetisch is
- Een lijst met paramagnetische atomen
- Paramagnetische verbindingen
Alle atomen reageren op een of andere manier op magnetische velden, maar ze reageren verschillend, afhankelijk van de configuratie van de atomen die de kern omringen. Afhankelijk van deze configuratie kan een element diamagnetisch, paramagnetisch of ferromagnetisch zijn. Diamagnetische elementen - en dat zijn ze eigenlijk allemaal tot op zekere hoogte - worden zwak afgestoten door een magnetisch veld, terwijl paramagnetische elementen zwak worden aangetrokken en gemagnetiseerd kunnen worden. Ferromagnetische materialen kunnen ook gemagnetiseerd worden, maar in tegenstelling tot paramagnetische elementen is de magnetisatie permanent. Zowel paramagnetisme als ferromagnetisme zijn sterker dan diamagnetisme, dus elementen die paramagnetisme of ferromagnetisme vertonen, zijn niet langer diamagnetisch.
Slechts enkele elementen zijn ferromagnetisch bij kamertemperatuur. Ze omvatten ijzer (Fe), nikkel (Ni), kobalt (Co), gadolinium (Gd) en - zoals wetenschappers recent ontdekten - ruthenium (Ru). U kunt een permanente magneet maken met elk van deze metalen door deze bloot te stellen aan een magnetisch veld. De lijst met paramagnetische atomen is veel langer. Een paramagnetisch element wordt magnetisch in aanwezigheid van een magnetisch veld, maar verliest zijn magnetische eigenschappen zodra u het veld verwijdert. De reden voor dit gedrag is de aanwezigheid van een of meer niet-gepaarde elektronen in de buitenste orbitale schaal.
Paramagnetische versus diamagnetische elementen
Een van de belangrijkste ontdekkingen in de wetenschap in de afgelopen 200 jaar is de onderlinge verbondenheid van elektriciteit en magnetisme. Omdat elk atoom een wolk van negatief geladen elektronen heeft, heeft het potentieel voor magnetische eigenschappen, maar of het ferromagnetisme, paramagnetisme of diamagnetisme vertoont, hangt af van hun configuratie. Om dit te waarderen, is het noodzakelijk om te begrijpen hoe elektronen beslissen welke banen ze rond de kern bezetten.
De elektronen hebben een kwaliteit genaamd spin, die u kunt visualiseren als draairichting, hoewel het ingewikkelder is dan dat. Elektronen kunnen "spin-up" (die u kunt visualiseren als rotatie met de klok mee) of "spin-down" (tegen de klok in) hebben. Ze rangschikken zichzelf op toenemende, strikt gedefinieerde afstanden van de kern die shells wordt genoemd, en binnen elke shell zijn subshells die een discreet aantal orbitalen hebben die kunnen worden bezet door maximaal twee elektronen, die elk tegengestelde spin hebben. Van twee elektronen die een baan bezetten wordt gezegd dat ze gekoppeld zijn. Hun spins annuleren en ze creëren geen netto magnetisch moment. Aan de andere kant is een enkel elektron dat een baan bezet, ongepaard en dit resulteert wel in een netto magnetisch moment.
Diamagnetische elementen zijn elementen zonder ongepaarde elektronen. Deze elementen verzetten zich zwak tegen een magnetisch veld, dat wetenschappers vaak aantonen door een diamagnetisch materiaal, zoals pyrolitisch grafiet of een kikker (ja, een kikker!) Boven een sterke elektromagneet te laten zweven. Paramagnetische elementen zijn elementen die niet-gepaarde elektronen hebben. Ze geven het atoom een netto magnetisch dipoolmoment, en wanneer een veld wordt toegepast, richten de atomen zich op het veld en wordt het element magnetisch. Wanneer u het veld verwijdert, komt thermische energie tussen om de uitlijning willekeurig te maken en gaat het magnetisme verloren.
Berekenen of een element paramagnetisch of diamagnetisch is
Elektronen vullen schalen rond de kern op een manier die de netto-energie minimaliseert. Wetenschappers hebben drie regels ontdekt die ze volgen wanneer ze dit doen, bekend als het Aufbrau-principe, de Hunds-regel en het Pauli-uitsluitingsprincipe. Door deze regels toe te passen, kunnen chemici bepalen hoeveel elektronen elk van de subschalen omringen die een kern omringen.
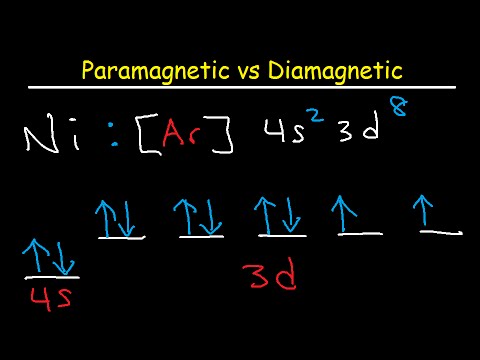
Om te bepalen of een element diamagnetisch of paramagnetisch is, is het alleen nodig om naar de valentie-elektronen te kijken, die de buitenste subschaal bezetten. Als de buitenste subschaal orbitalen met niet-gepaarde elektronen bevat, is het element paramagnetisch. Anders is het diamagnetisch. Wetenschappers identificeren de subschalen als s, p, d en f. Bij het schrijven van de elektronenconfiguratie is de conventie om aan de valentie-elektronen vooraf te gaan door het edelgas dat voorafgaat aan het betreffende element in het periodiek systeem. Edele gassen hebben volledig gevulde elektronenorbitalen, daarom zijn ze inert.
De elektronenconfiguratie voor magnesium (Mg) is bijvoorbeeld 3s2. De buitenste subschaal bevat twee elektronen, maar ze zijn niet gekoppeld, dus magnesium is paramagnetisch. Anderzijds is de elektronenconfiguratie van zink (Zn) 4s23d10. Het heeft geen ongepaarde elektronen in zijn buitenste schil, dus zink is diamagnetisch.
Een lijst met paramagnetische atomen
Je zou de magnetische eigenschappen van elk element kunnen berekenen door hun elektronenconfiguraties uit te schrijven, maar dat hoeft gelukkig niet. Chemici hebben al een tabel met paramagnetische elementen gemaakt. Ze zijn als volgt:
Paramagnetische verbindingen
Wanneer atomen combineren om verbindingen te vormen, kunnen sommige van die verbindingen ook paramagnetisme vertonen om dezelfde reden dat elementen dat doen. Als er een of meer niet-gepaarde elektronen in de orbitalen van de verbinding aanwezig zijn, is de verbinding paramagnetisch. Voorbeelden omvatten moleculaire zuurstof (O2), ijzeroxide (FeO) en stikstofoxide (NO). In het geval van zuurstof is het mogelijk om dit paramagnetisme weer te geven met behulp van een sterke elektromagneet. Als u vloeibare zuurstof tussen de polen van een dergelijke magneet giet, verzamelt de zuurstof zich rond de polen terwijl deze verdampt om een wolk van zuurstofgas te creëren. Probeer hetzelfde experiment met vloeibare stikstof (N2), wat niet paramagnetisch is, en er zal zich geen dergelijke wolk vormen.
Als u een lijst met paramagnetische verbindingen zou willen samenstellen, zou u elektronenconfiguraties moeten onderzoeken. Omdat het de ongepaarde elektronen in de buitenschalen zijn die paramagnetische eigenschappen verlenen, zouden verbindingen met dergelijke elektronen de lijst kunnen vormen. Dit is echter niet altijd waar. In het geval van het zuurstofmolecuul is er een even aantal valentie-elektronen, maar deze nemen elk een lagere energietoestand in om de algehele energietoestand van het molecuul te minimaliseren. In plaats van een elektronenpaar in een hogere baan, zijn er twee ongepaarde elektronen in lagere orbitalen, waardoor het molecuul paramagnetisch is.