Inhoud
- The Science of Thermodynamics
- Wat is warmtecapaciteit?
- Warmtecapaciteit: eenvoudige berekeningen
- Wat is de Cp tot Cv-verhouding γ?
- De Cp en Cv of Air
Warmte capaciteit is een term in de natuurkunde die beschrijft hoeveel warmte aan een stof moet worden toegevoegd om de temperatuur met 1 graad Celsius te verhogen. Dit is gerelateerd aan, maar verschilt van, specifieke hitte, dat is de hoeveelheid warmte die nodig is om precies 1 gram (of een andere vaste massa-eenheid) van een stof met 1 graad Celsius te verhogen. Een warmtecapaciteit van een stof C afleiden van zijn specifieke warmte S is een kwestie van vermenigvuldigen met de hoeveelheid van de stof die aanwezig is en ervoor zorgen dat u gedurende het hele probleem dezelfde massa-eenheden gebruikt. Warmtecapaciteit, in eenvoudige bewoordingen, is een index van het vermogen van een object om weerstand te bieden tegen verwarmen door toevoeging van warmte-energie.
Materie kan bestaan als een vaste stof, een vloeistof of een gas. In het geval van gassen kan de warmtecapaciteit afhangen van zowel de omgevingsdruk als de omgevingstemperatuur. Wetenschappers willen vaak de warmtecapaciteit van een gas bij een constante druk weten, terwijl andere variabelen zoals temperatuur mogen veranderen; dit staat bekend als de Cp. Evenzo kan het nuttig zijn om een gaswarmingscapaciteit bij een constant volume of C te bepalenv. De verhouding van Cp naar Cv biedt vitale informatie over de thermodynamische eigenschappen van een gas.
The Science of Thermodynamics
Voordat u begint met een bespreking van warmtecapaciteit en specifieke warmte, is het nuttig om eerst de basisprincipes van warmteoverdracht in de fysica en het concept van warmte in het algemeen te begrijpen, en uzelf vertrouwd te maken met enkele van de fundamentele vergelijkingen van de discipline.
Thermodynamica is de tak van de fysica die zich bezighoudt met het werk en de energie van een systeem. Werk, energie en warmte hebben allemaal dezelfde eenheden in de natuurkunde, ondanks dat ze verschillende betekenissen en toepassingen hebben. De SI (standaard internationale) warmte-eenheid is de joule. Werk wordt gedefinieerd als kracht vermenigvuldigd met afstand, dus met het oog op de SI-eenheden voor elk van deze hoeveelheden is een joule hetzelfde als een newton-meter. Andere eenheden die u waarschijnlijk tegenkomt voor warmte zijn de calorie (cal), Britse thermische eenheden (btu) en de erg.(Merk op dat de "calorieën" die je op voedselvoedingsetiketten ziet, eigenlijk kilocalorieën zijn, waarbij "kilo-" het Griekse voorvoegsel is dat "duizend" aangeeft; dus als je ziet dat een blikje frisdrank van 120 gram 120 bevat " calorieën, "dit is eigenlijk formeel gelijk aan 120.000 calorieën in formele fysieke termen.)
Gassen gedragen zich anders dan vloeistoffen en vaste stoffen. Daarom hebben natuurkundigen in de wereld van aerodynamica en aanverwante disciplines, die van nature zeer bezorgd zijn over het gedrag van lucht en andere gassen in hun werk met hogesnelheidsmotoren en vliegmachines, speciale zorgen over de warmtecapaciteit en andere kwantificeerbare fysische parameters gerelateerd er toe doen in deze staat. Een voorbeeld is enthalpie, wat een maat is voor de interne warmte van een gesloten systeem. Het is de som van de energie van het systeem plus het product van de druk en het volume:
H = E + PV
Meer specifiek houdt de verandering in enthalpie verband met de verandering in gasvolume door de relatie:
∆H = E + P∆V
Het Griekse symbool ∆, of delta, betekent "verandering" of "verschil" volgens afspraak in natuurkunde en wiskunde. Bovendien kunt u controleren of druk maal volume werkeenheden oplevert; druk wordt gemeten in newton / m2, terwijl het volume kan worden uitgedrukt in m3.
Ook zijn de druk en het volume van een gas gerelateerd door de vergelijking:
P∆V = R∆T
waarbij T de temperatuur is en R een constante is die voor elk gas een andere waarde heeft.
U hoeft deze vergelijkingen niet in het geheugen op te nemen, maar ze zullen later opnieuw worden besproken in de discussie over Cp en Cv.
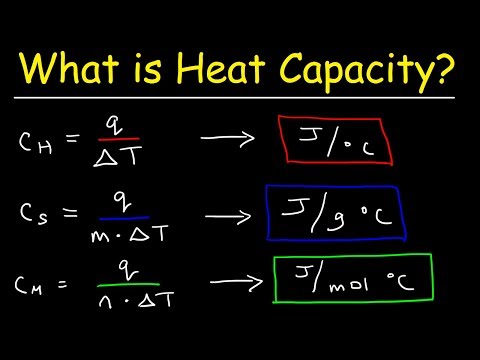
Wat is warmtecapaciteit?
Zoals opgemerkt zijn warmtecapaciteit en soortelijke warmte verwante hoeveelheden. De eerste komt eigenlijk voort uit de tweede. Specifieke warmte is een toestandsvariabele, wat betekent dat deze alleen betrekking heeft op de intrinsieke eigenschappen van een stof en niet op hoeveel daarvan aanwezig is. Het wordt daarom uitgedrukt als warmte per massa-eenheid. Warmtecapaciteit hangt daarentegen af van hoeveel van de stof in kwestie een warmteoverdracht ondergaat en het is geen toestandsvariabele.
Aan alle materie is een temperatuur verbonden. Dit is misschien niet het eerste waar je aan denkt als je een object opmerkt ("Ik vraag me af hoe warm dat boek is?"), Maar onderweg heb je misschien geleerd dat wetenschappers er nooit in zijn geslaagd een temperatuur van absoluut nul te bereiken onder alle omstandigheden, hoewel ze pijnlijk dichtbij zijn gekomen. (De reden dat mensen proberen zoiets te doen, heeft te maken met de extreem hoge geleidbaarheidseigenschappen van extreem koude materialen; denk maar aan de waarde van een fysieke elektriciteitsgeleider met vrijwel geen weerstand.) Temperatuur is een maat voor de beweging van moleculen . In vaste materialen is materie in een rooster of rooster gerangschikt en kunnen moleculen niet bewegen. In een vloeistof zijn moleculen vrijer om te bewegen, maar ze zijn nog steeds in grote mate beperkt. In een gas kunnen moleculen heel vrij bewegen. Onthoud in elk geval dat lage temperatuur weinig moleculaire beweging inhoudt.
Wanneer u een object, inclusief uzelf, van de ene fysieke locatie naar de andere wilt verplaatsen, moet u energie verbruiken - of anders werken - om dit te doen. Je moet opstaan en door een kamer lopen, of je moet het gaspedaal van een auto indrukken om brandstof door zijn motor te dwingen en de auto te dwingen te bewegen. Evenzo is op microniveau een input van energie in een systeem vereist om zijn moleculen te laten bewegen. Als deze input van energie voldoende is om een toename van de moleculaire beweging te veroorzaken, dan impliceert dit op basis van de bovenstaande discussie noodzakelijkerwijs dat de temperatuur van de stof ook stijgt.
Verschillende veel voorkomende stoffen hebben sterk variërende waarden van specifieke warmte. Onder metalen, bijvoorbeeld, controleert goud bij 0,129 J / g ° C, wat betekent dat 0,129 joule warmte voldoende is om de temperatuur van 1 gram goud met 1 graad Celsius te verhogen. Vergeet niet dat deze waarde niet verandert op basis van de hoeveelheid goud die aanwezig is, omdat de massa al in de noemer van de specifieke warmte-eenheden is opgenomen. Dat is niet het geval voor warmtecapaciteit, zoals u snel zult ontdekken.
Warmtecapaciteit: eenvoudige berekeningen
Het verbaast veel studenten van de inleidende fysica dat de soortelijke warmte van water, 4.179, aanzienlijk hoger is dan die van gewone metalen. (In dit artikel worden alle waarden van specifieke warmte gegeven in J / g ° C.) Ook is de warmtecapaciteit van ijs, 2,03, minder dan de helft van die van water, hoewel beide bestaan uit H2O. Dit laat zien dat de toestand van een verbinding, en niet alleen de moleculaire samenstelling ervan, de waarde van zijn soortelijke warmte beïnvloedt.
Stel dat u in elk geval wordt gevraagd om te bepalen hoeveel warmte nodig is om de temperatuur van 150 g ijzer (met een specifieke warmte of S van 0,450) met 5 ° C te verhogen. Hoe zou u dit doen?
De berekening is heel eenvoudig; vermenigvuldig de soortelijke warmte S met de hoeveelheid materiaal en de verandering in temperatuur. Aangezien S = 0.450 J / g ° C, is de hoeveelheid warmte die moet worden toegevoegd in J (0.450) (g) (∆T) = (0.450) (150) (5) = 337.5 J. Een andere manier om uit te drukken dit wil zeggen dat de warmtecapaciteit van 150 g ijzer 67,5 J is, wat niets meer is dan de soortelijke warmte S vermenigvuldigd met de massa van de aanwezige stof. Het is duidelijk dat, hoewel de warmtecapaciteit van vloeibaar water constant is bij een gegeven temperatuur, het veel meer warmte kost om een van de Grote Meren zelfs een tiende graad te verwarmen dan het zou duren om een pint water met 1 graad te verwarmen , of 10 of zelfs 50.
Wat is de Cp tot Cv-verhouding γ?
In een vorige paragraaf maakte u kennis met het idee van voorwaardelijke warmtecapaciteiten voor gassen - dat wil zeggen warmtecapaciteitswaarden die van toepassing zijn op een bepaalde stof onder omstandigheden waarin ofwel de temperatuur (T) of de druk (P) constant wordt gehouden door het probleem heen. Je kreeg ook de basisvergelijkingen ∆H = E + P∆V en P∆V = R∆T.
Je kunt aan de laatste twee vergelijkingen zien dat een andere manier om verandering in enthalpie, ∆H uit te drukken, is:
E + R∆T
Hoewel hier geen afleiding wordt gegeven, is een manier om de eerste wet van de thermodynamica uit te drukken, die van toepassing is op gesloten systemen en die je misschien in de volksmond hebt horen zeggen: "Energie wordt niet gecreëerd of vernietigd,"
∆E = CvAT
In gewone taal betekent dit dat wanneer een bepaalde hoeveelheid energie wordt toegevoegd aan een systeem inclusief een gas, en het volume van dat gas niet mag veranderen (aangegeven door het subscript V in Cv), de temperatuur moet recht evenredig stijgen met de waarde van de warmtecapaciteit van dat gas.
Een andere relatie bestaat tussen deze variabelen die de afleiding van warmtecapaciteit bij constante druk mogelijk maakt, Cp, in plaats van een constant volume. Deze relatie is een andere manier om enthalpie te beschrijven:
∆H = CpAT
Als u handig bent in algebra, kunt u tot een kritische relatie tussen C komenv en Cp:
Cp = Cv + R
Dat wil zeggen dat de warmtecapaciteit van een gas bij constante druk groter is dan zijn warmtecapaciteit bij constant volume met een constante R die verband houdt met de specifieke eigenschappen van het te onderzoeken gas. Dit is intuïtief logisch; als je je voorstelt dat een gas mag uitzetten als reactie op toenemende interne druk, kun je waarschijnlijk waarnemen dat het minder hoeft op te warmen als reactie op een bepaalde toevoeging van energie dan als het beperkt zou zijn tot dezelfde ruimte.
Ten slotte kunt u al deze informatie gebruiken om een andere stofspecifieke variabele te definiëren, γ, die de verhouding C isp naar Cvof Cp/ Cv. Je kunt aan de vorige vergelijking zien dat deze verhouding toeneemt voor gassen met hogere waarden van R.
De Cp en Cv of Air
De Cp en Cv van lucht zijn beide belangrijk in de studie van vloeistofdynamica omdat lucht (bestaande uit een mengsel van voornamelijk stikstof en zuurstof) het meest voorkomende gas is dat mensen ervaren. Beide Cp en Cv temperatuurafhankelijk zijn en niet precies in dezelfde mate; als het gebeurt, Cv stijgt iets sneller met toenemende temperatuur. Dit betekent dat de "constante" y in feite niet constant is, maar het is verrassend dichtbij een bereik van waarschijnlijke temperaturen. Bijvoorbeeld, bij 300 graden Kelvin of K (gelijk aan 27 ° C), is de waarde van y 1.400; bij een temperatuur van 400 K, dat 127 ° C is en aanzienlijk boven het kookpunt van water, is de waarde van y 1.395.