Inhoud
Wanneer twee elementen reageren, vormen ze een verbinding door elektronen te delen, te doneren of te accepteren. Wanneer twee aanzienlijk verschillende elementen binden, zoals een metaal en een niet-metaal, regelt één element meestal de andere elektronen. Hoewel het niet strikt nauwkeurig is om te zeggen dat er geen delen plaatsvindt, is het delen zo sterk in het voordeel van één element, dat voor alle praktische doeleinden wordt gezegd dat zijn partner zijn elektron heeft gedoneerd of "verloren".
Elektronegativiteit
Elektronegativiteit beschrijft de neiging van een element om elektronen te winnen. Dit kenmerk werd formeel gedefinieerd door Linus Pauling in 1932, die ook de kwantitatieve meting van de elektronegativiteit ontwikkelde die tegenwoordig de Pauling-schaal wordt genoemd. De elementen die het meest waarschijnlijk elektronen verliezen in een reactie zijn die elementen die het laagst zijn op de Pauling-schaal, of die het meest elektropositief zijn. Aangezien de elektronegativiteit over het algemeen toeneemt als je van de linkeronderhoek van het periodiek systeem naar de rechterbovenhoek gaat, vallen de elementen onderaan groep 1A het laagst op de schaal, waarbij cesium en francium een 0,7 scoren. Bij vrijwel elke reactie verliezen de alkalimetalen in groep 1A en de aardalkalimetalen in groep 2A hun elektronen aan hun meer elektronegatieve partners.
Ionische bindingen
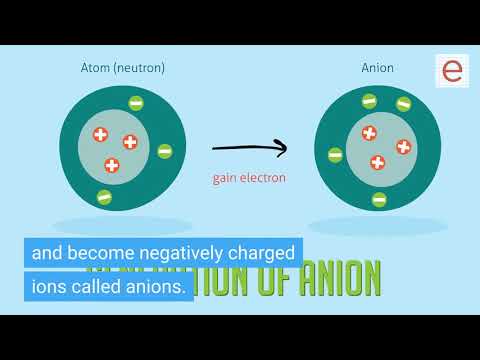
Wanneer twee elementen a met significant verschil in elektronegativiteit reageren, wordt een ionische binding gevormd. In tegenstelling tot een covalente binding, waarbij de buitenelektronen van beide atomen worden gedeeld, verliest het meer elektropositieve element in een ionische binding het grootste deel van zijn controle over zijn elektron. Wanneer dit gebeurt, worden beide elementen "ionen" genoemd. Het element dat zijn elektron heeft verloren, wordt een "kation" genoemd en wordt altijd als eerste in de chemische naam vermeld. Het kation in natriumchloride (keukenzout) is bijvoorbeeld het alkalimetaalnatrium. Het element dat het elektron uit het kation accepteert, wordt het "anion" genoemd en krijgt het achtervoegsel "-ide", zoals in chloride.
Redox-reacties
Een element in zijn natuurlijke staat heeft een gelijk aantal protonen en elektronen, waardoor het een netto lading van nul heeft; wanneer een element echter een elektron verliest als onderdeel van een chemische reactie, wordt het positief geladen of geoxideerd. Tegelijkertijd wordt het element dat het elektron heeft gebruikt meer negatief geladen of gereduceerd. Deze reacties worden reductie-oxidatie of "redox" -reacties genoemd. Omdat de elektronendonor of geoxideerd element ervoor zorgt dat een ander element wordt gereduceerd, wordt dit het reductiemiddel genoemd.
Lewis Bases
Een Lewis-base is een element, ion of verbinding die een ongebonden paar elektronen verliest aan een ander element, ion of verbinding. Aangezien het meer elektropositieve element altijd zijn elektronen verliest, is dit altijd de soort die de Lewis-basis wordt. Merk echter op dat niet alle Lewis-basen hun elektronen volledig verliezen; wanneer bijvoorbeeld twee niet-metalen binden, worden de elektronen vaak gedeeld, zij het ongelijk. Wanneer een metaal met een niet-metaal bindt, is het resultaat echter een Lewis-base met een ionische binding, waarin het metaal voor alle praktische doeleinden zijn elektronenpaar heeft verloren.