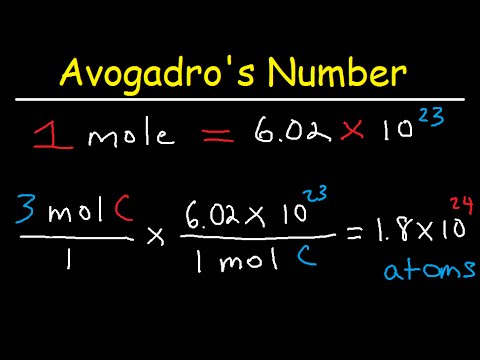
Inhoud
- Bepaling van de molaire massa van een element
- Bepaal de moleculaire massa van een chemische verbinding
- Converteren van massa naar mollen
In de chemie is een mol een hoeveelheid die wordt gebruikt om reagentia te relateren aan producten in stoïchiometrische vergelijkingen. Een mol van een stof is gelijk aan 6,02 x 10 ^ 23 deeltjes - meestal atomen of moleculen - van die stof. Voor een gegeven element wordt de massa (in grammen) van één mol gegeven door zijn massagetal op het periodiek systeem; de "molaire massa" van een molecuul is de som van de molaire massa's van de elementen in het molecuul in de juiste verhoudingen. Het is eenvoudig om de molmassa van elementen en moleculen te bepalen met behulp van het periodiek systeem, en om te rekenen tussen gram en mol.
Bepaling van de molaire massa van een element
- ••• Jupiterimages / Photos.com / Getty Images
Zoek het element lithium (Li) op het periodiek systeem. Het atoomnummer voor lithium is 3, dat het aantal protonen in de kern van één atoom weergeeft.
Merk op dat het massagetal van lithium 6,94 is, wat de som is van het aantal protonen en neutronen in de kern van één atoom.
Merk op dat het massagetal gelijk is aan de massa (in gram) van één mol lithium; dit is de molaire massa van lithium.
Bepaal de moleculaire massa van een chemische verbinding

Bepaal de moleculaire massa van kooldioxide (chemische formule CO2). Vind koolstof en zuurstof op het periodiek systeem.
Let op de massa's koolstof en zuurstof uit het periodiek systeem, die respectievelijk 12.01 en 16 zijn.
Voeg de massacijfers van één koolstofatoom en twee zuurstofatomen uit het periodiek systeem toe: 12.01 + 2 (16) = 44.01 gram per mol
Converteren van massa naar mollen
Bereken het aantal mol water in 600 gram water (H2O). Vind waterstof en zuurstof op het periodiek systeem.
Stel de volgende vergelijking in met betrekking tot gram tot mol:
x mol H2O = (1 mol H2O / 18 gram H2O) x (600 gram H2O)
Los de vergelijking in stap 2 op om te ontdekken dat er 3,33 mol H2O is in 600 gram H2O.