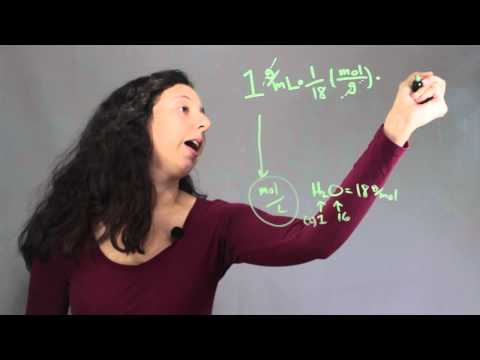
Inhoud
- TL; DR (te lang; niet gelezen)
- Een mol en molariteit definiëren
- Molariteit omzetten in dichtheid
- Dichtheid omzetten in molariteit
Molariteit en dichtheid zijn verschillende manieren om in wezen hetzelfde uit te drukken. Terwijl de dichtheid de massa is van een vaste stof, vloeistof of gas gedeeld door het volume, is molariteit het aantal mol opgeloste stof per liter oplossing. Een mol van een verbinding is de atoommassa van zijn samenstellende atomen in gram, en een liter is een maat voor volume, dus molariteit is ook een maat voor dichtheid. Chemici geven er de voorkeur aan om molariteit te gebruiken omdat hierdoor vele vergelijkingen, zoals de ideale gaswet, in bredere omstandigheden kunnen worden toegepast. Het maakt sommige berekeningen echter eenvoudiger als alle hoeveelheden in dichtheidseenheden zijn.
TL; DR (te lang; niet gelezen)
Molariteit is het aantal mol opgeloste stof per liter oplossing. Converteer naar dichtheid door het aantal mol te vermenigvuldigen met de moleculaire massa van de verbinding. Converteer dichtheid naar molariteit door deze om te rekenen naar gram per liter en te delen door de moleculaire massa van de verbinding in gram.
Een mol en molariteit definiëren
Een mol is een eenheid die chemici gebruiken om massa te meten. Een mol van een verbinding heeft exact hetzelfde aantal deeltjes als 12 gram koolstof-12, wat het Avogadros-getal is (6,02 x 1023) van deeltjes. De massa van hetzelfde aantal deeltjes van een verbinding hangt af van de atoommassa's van de atomen die deze vormen. Bijvoorbeeld. een mol waterstofgas (H2) heeft een massa van 2,016 gram, omdat de gemiddelde atoommassa van alle waterstofisotopen 1,008 AMU (atomaire massa-eenheden) is. Evenzo is een mol methaangas (CH4) heeft een massa van 16.043 gram, omdat de massa koolstof, wanneer u alle natuurlijk voorkomende isotopen in ogenschouw neemt, 12.011 is.
Chemici gebruiken molariteit om de concentratie van een opgeloste stof in oplossing te meten. Molariteit (M) is het aantal mol opgeloste stof in een liter oplossing. Natriumchloride (NaCl) heeft een molecuulmassa van (22,99 + 35,45) = 58,44 AMU, dus als u 58,44 gram tafelzout oplost in een liter water, hebt u een 1 M (1 molaire) oplossing.
Molariteit omzetten in dichtheid
De molariteit van een opgeloste stof is een maat voor de dichtheid van die opgeloste stof, en je berekent de een vrij gemakkelijk van de ander. Beschouw het voorbeeld van 1 M oplossing van NaCl. Het bevat 58,44 gram NaCl per liter oplossing, dus de dichtheid van NaCl in oplossing is 58,44 gram / liter. Als u in plaats daarvan een 1,05 M NaCl-oplossing hebt, vermenigvuldigt u eenvoudig de molariteit met de moleculaire massa van NaCl om de dichtheid in gram per liter te vinden: (1,05 * 58,44) = 61,32 g / l. Berekeningen zijn meestal eenvoudiger als u de dichtheid omzet in gram / milliliter door het resultaat met 10 te vermenigvuldigen-3. Dus 58,44 g / l wordt 0,05844 g / ml en 61,32 g / l wordt 0,06132 g / ml.
Dichtheid omzetten in molariteit
De omgekeerde procedure, waarbij de dichtheid van opgeloste stof in oplossing wordt omgezet in molariteit, is niet moeilijk. Converteer de dichtheid van de opgeloste stof naar gram / liter en deel het resultaat door de moleculaire massa van de opgeloste stof. Overweeg bijvoorbeeld een oplossing waarbij de dichtheid van natriumchloride 0,036 g / ml is. Vermenigvuldig met 103 omrekenen naar g / l = 36 g / l. Deel door het molecuulgewicht van NaCl (58,44 g): 36 g / l - 58,44 g / mol = 6,16 mol / l = 0,62 M.