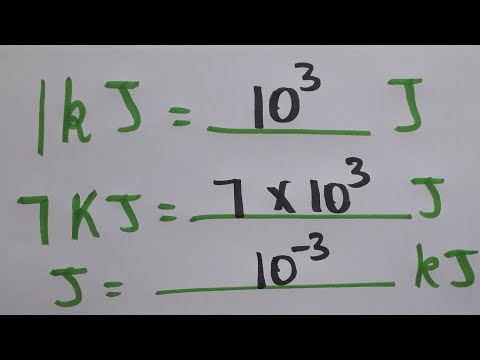
Inhoud
Het verschil tussen warmte en temperatuur kan een moeilijk begrip zijn. Warmte is in wezen de totale hoeveelheid kinetische energie die de moleculen van een stof hebben en wordt gemeten in eenheden joules (J). Temperatuur is gerelateerd aan de gemiddelde kinetische energie van de afzonderlijke moleculen en wordt gemeten in graden. Het toepassen van dezelfde hoeveelheid warmte op verschillende materialen zal resulteren in verschillende niveaus van temperatuurstijgingen, afhankelijk van de specifieke warmtecapaciteit van de stof. U kunt de eindtemperatuur berekenen als u de hoeveelheid van de stof en de specifieke warmtecapaciteit ervan kent.
Deel de hoeveelheid warmte-energie die aan de stof wordt geleverd, in joules, door de massa van de stof, in gram (g). Als er bijvoorbeeld 4.000 joule energie aan 500 g water wordt verstrekt, zou je 4.000 / 500 = 8 berekenen.
Deel het resultaat van de vorige berekening door de specifieke warmtecapaciteit van de stof. Over het algemeen kunt u de specifieke warmtecapaciteit van een chemische stof verkrijgen uit de literatuur van de fabrikant of van een wetenschappelijke referentiebron zoals het CRC Handbook of Chemistry and Physics. Het resultaat van deze berekening is de temperatuurstijging van de stof, in eenheden van graden Celsius. De specifieke warmtecapaciteit van water is g / 4,19 J - graden Celsius. In het voorbeeld zou de berekening 8 / 4,19 = 1,9 graden Celsius zijn.
Voeg de zojuist afgeleide temperatuurverhoging toe aan de stof. Dit geeft u de temperatuur na de warmte-invoer.Als het water in het voorbeeld aanvankelijk 25 graden was geweest, zou de temperatuur na verwarming 25 + 1,9 = 26,9 graden Celsius zijn.
Voeg 273,1 toe aan de uiteindelijke temperatuur van de stof die zojuist is berekend. Dit is de omrekeningsfactor die moet worden gewijzigd van eenheden van graden Celsius naar Kelvin (K). Het resultaat is de temperatuur van het materiaal na de warmte-invoer in Kelvin. De watertemperatuur zou 26,9 + 273,1 = 300 K zijn.