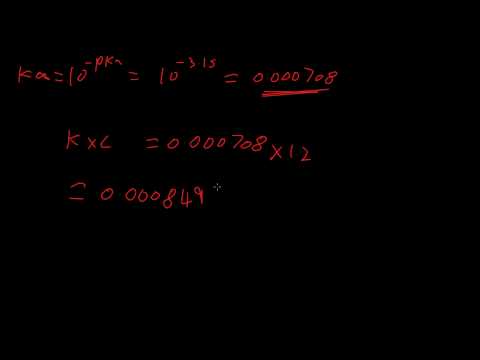
Inhoud
De sterkte van een zuur wordt gemeten door zowel de pH als de pKa, en de twee zijn gerelateerd door de Henderson-Hasslebalch-vergelijking. Deze vergelijking is: pH = pKa + log /, waar is de concentratie van het zuur en is de concentratie van zijn geconjugeerde base na dissociatie. pH is een variabele die afhankelijk is van de concentratie, dus als u de waarde van deze relatie wilt afleiden, moet u de concentraties van het zuur en de geconjugeerde base kennen.
Wat zijn pH en pKa?
De afkorting pH staat voor "kracht van waterstof" en is een maat voor de concentratie van waterstofionen in een waterige oplossing. De volgende vergelijking geeft deze relatie weer:
pH = -log
De waarde van pKa hangt daarentegen af van de concentraties van zuur en geconjugeerde base in oplossing nadat de zuurdissociatie evenwicht heeft bereikt. De verhouding van de concentraties van conjugaatbase en conjugaatzuur tot het betreffende zuur, in een waterige oplossing, wordt de dissociatieconstante Ka genoemd. De waarde voor pKa wordt gegeven door:
pKa = -log (Ka)
Hoewel de pH per oplossing varieert, is pKa een constante voor elk zuur.
Henderson-Hasselbalch-vergelijking
De formule Henderson-Hasselbalch komt rechtstreeks uit de definitie van de dissociatieconstante Ka. Voor een zuur HA dat dissocieert in H+ en een- in water wordt de dissociatieconstante gegeven door:
Ka = /
We kunnen het logaritme van beide kanten nemen:
log (Ka) = log (/), of log Ka = log (H +) + log /
Verwijzend naar de definities van pH en pKa wordt dit:
-pKa = -pH + log /
Ten slotte, na toevoeging van pH en pKa aan beide zijden:
pH = pKa + log /.
Met deze vergelijking kunt u de pH berekenen als de dissociatieconstante, pKa en de concentraties van het zuur en de geconjugeerde base bekend zijn.