Inhoud
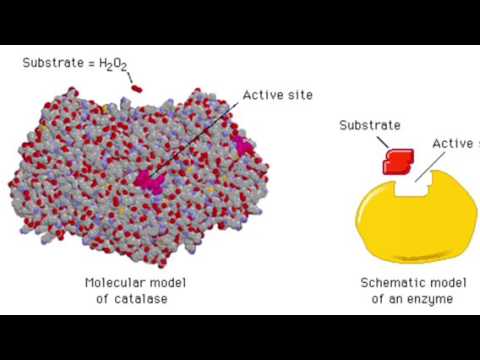
Het katalase-enzym is een van de meest efficiënte enzymen die bekend zijn, omdat elk enzym bijna 800.000 katalytische gebeurtenissen per seconde kan uitvoeren. De belangrijkste catalase-functie is het beschermen van cellen tegen waterstofperoxide (H2O2) moleculen door ze om te zetten in zuurstof (O2) en water (H2O). H2O2 kan DNA beschadigen.
Catalase wordt gevormd door vier afzonderlijke delen, of monomeren, die zich in een haltervormig enzym wikkelen. Elk monomeer heeft een katalytisch centrum dat een heemmolecuul bevat, dat zuurstof bindt. Elk monomeer bindt ook een NADPH-molecule, die het enzym zelf beschermt tegen de schadelijke effecten van H2O2.
Catalase werkt het beste bij een pH van 7 en is zeer overvloedig aanwezig in peroxisomen, de zakjes in een cel die toxische moleculen afbreken.
Catalase-structuur: All Four One en One for All
Catalase is een vierdelig enzym of een tetrameer. Vier monomeren wikkelen zich om elkaar en vormen een haltervormig enzym. Elk monomeer heeft vier domeinen of delen - zoals lichaamsdelen die verschillende dingen doen.
Het tweede domein is het domein dat de heemgroep bevat. Het derde domein staat bekend als het omhullende domein, waar de vier monomeren zich om elkaar heen wikkelen om een tetrameer te vormen.
Veel zoutbruggen, of ionische interacties tussen positief en negatief geladen zijketens van aminozuren, houden de vier monomeren bij elkaar. De monomeren weven om elkaar heen, waardoor het tetrameer-enzym zeer stabiel is.
Het draagt hulpmiddelen
Elk monomeer van het catalase-tetrameer bevat één heemgroep. Heemgroepen zijn schijfvormige moleculen met in het midden een ijzeratoom dat zuurstof bindt. De heem is begraven in het midden van het katalytische domein van elk monomeer. Elk catalase-monomeer bindt ook een NADPH-molecuul, maar aan zijn oppervlak.
De NADPH is er om het enzym tegen de H te beschermen2O2 (waterstofperoxide) dat het moet katalyseren. Een H2O2 molecuul kan een superoxide molecuul worden, dat zijn twee zuurstofatomen die aan elkaar zijn gebonden, waarbij een van hen een extra elektron heeft dat zeer reactief is - wat betekent dat het kan interageren met de elektronen in chemische bindingen op andere moleculen en die bindingen verbreken.
Het is zo snel
Zuurstofradicalen, zoals H2O2, worden geproduceerd door normale cellulaire processen. Omdat ze gevaarlijk zijn voor de cel, moeten ze worden omgezet in goedaardige moleculen.
Catalase is een van de snelste bekende enzymen. Elk monomeer in het catalase-tetrameer kan bijna 200.000 katalytische gebeurtenissen per seconde uitvoeren. Omdat een tetrameer vier monomeren heeft, kan elk catalase-enzym bijna 800.000 katalytische gebeurtenissen per seconde uitvoeren.
Catalase heeft dit efficiëntieniveau nodig omdat H2O2 is gevaarlijk voor de cel. Catalase-enzymen hopen zich op in zakjes die peroxisomen in een cel worden genoemd. Peroxisomen zijn blaasjes die moleculen afbreken die giftig zijn voor de cel, inclusief zuurstofradicalen zoals H2O2.
Neutrale pH
Onderzoekers hebben de activiteit van catalase bestudeerd bij een pH van 7,4 en bij 25 graden Celsius (77 graden Fahrenheit). De optimale pH voor de katalasereactie is ongeveer 7, dus een manier waarop onderzoekers de katalase-activiteit in een reageerbuis stoppen, is de pH te veranderen door een sterk zuur of een sterke base toe te voegen.
In de cel hoopt catalase zich op in peroxisomen, die verschillende pH's hebben wanneer gemeten in verschillende cellen. Het tijdschrift "IUBMB Life" meldde dat peroxisomen pH's hebben gevonden die variëren van 5.8-6.0, 6.9-7.1 en 8.2.
Verschillende peroxisomen kunnen dus verschillende hoeveelheden katalase bevatten, of kunnen de catalase in- of uitschakelen afhankelijk van hoe ze hun interne pH-niveau reguleren.