Inhoud
Drie manieren om protonenmassa te vinden, omvatten berekening uit theorie, uit atomaire molaire massa en lading / massa-vergelijkingen met elektronen. Het gebruik van theorie om te bepalen wat protonmassa zou moeten zijn, is alleen realistisch voor experts in het veld. Lading / massa en molaire massa berekeningen kunnen worden gedaan op bachelorniveau en middelbare schoolniveau.
Afleiden van protonenmassa uit kwantum- en relativiteitstheorieën. Protonen hebben een interne structuur - drie deeltjes (quarks) bij elkaar gehouden door aantrekkelijke krachten (gluonen). Naïeve veronderstellingen zouden elke quark 1/3 protonenmassa opleveren. Ongeveer 95 procent tot 98 procent van de protonenmassa wordt niet bijgedragen door quarkmassa. In werkelijkheid is de meeste protonenmassa afgeleid van interactie-energie tussen de quarks. Herinner "E = mc ^ 2" voor het geval er verwarring bestaat over de uitdrukking "massa is afgeleid van energie."
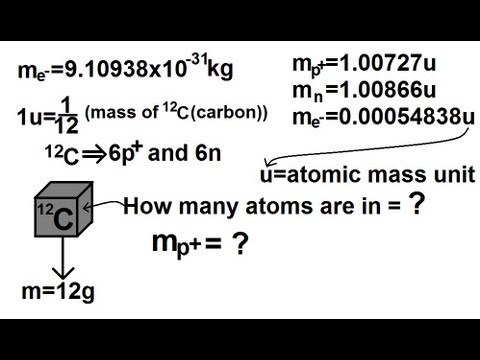
Bereken wetende molaire waterstofmassa. Een mol is gelijk aan 6.022e23, net zoals een dozijn gelijk is aan 12 of een paar gelijk is aan twee. We kunnen ervan uitgaan dat één mol waterstofatomen (geen "H2" -moleculen) 1,0079 g weegt. Elk waterstofatoom bevat één proton, dus weegt één mol protonen 1,0079 g. Omdat elke mol gelijk is aan 6.022e23-eenheden, weten we dat 6.022e23-protonen 1,0079 gram wegen. Het delen van 1,0079 g door het aantal mol (1,0079 / 6,022e23) geeft protonenmassa: 1,6737e-24 g.
Merk op dat waterstofatomen een elektron hebben om protonlading in evenwicht te brengen. Protonen zonder elektronen, hetzij als opgelost in oplossing of als plasma, verschillen sterk van waterstofatomen. Omdat de berekening daar niet stopt, kunnen we de fysieke absurditeit negeren door te doen alsof elektronen niet bestaan.
Houd er rekening mee dat de berekeningsmethode voor 'molaire massa' met elk element kan worden uitgevoerd. Drie bronnen van fouten sluipen echter op. Ten eerste zijn protonen in waterstofatomen niet gebonden. In andere elementen zijn protonen gebonden aan neutronen. Protonen gebonden in een kern hebben minder energie - dus iets minder massa - dan geïsoleerde protonen. Ten tweede begint het elektronennummer, en de fout als ze worden genegeerd, op te tellen. Accounting voor elektronen maakt het hele proces ingewikkelder. Ten slotte zijn zwaardere elementen radioactief. Overweeg vervalpaden, isotoop aanwezigheid, halfwaardetijden, etc. Nogmaals, de berekening is nog steeds mogelijk, maar het wordt moeilijker dan het moet zijn.
Gebruik ladings- / massaverhoudingen. Deze methode meet de kromming van deeltjes bij het betreden van geijkte elektrische en magnetische velden. De krommingsgrootte zou op protonenmassa wijzen vergeleken met elektronenmassa. Het experimentele idee lijkt op het beïnvloeden van de beweging van een rollende bal. Een constante mechanische kracht zal een zware watermeloen (proton) in geringe mate van rechte lijn afleiden. Dezelfde kracht zal een lichte golfbal (elektron) veel meer afbuigen.