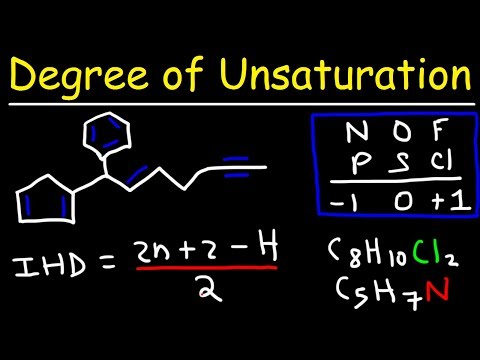
In de organische chemie is een "onverzadigde" verbinding een verbinding die ten minste één "pi" binding bevat - een "dubbele" binding tussen twee van zijn koolstofatomen die twee elektronen gebruikt van elke koolstof in plaats van één. Bepalen hoeveel pi-bindingen een onverzadigde verbinding heeft - het "onverzadigingsnummer" - is lastig om te doen als u ervoor kiest om de verbinding met de hand te tekenen. Als u daarentegen dit aantal berekent met een eenvoudige formule die chemici hebben bedacht, duurt het slechts enkele ogenblikken.
Vervang halogenen - zoals broom, jodium of chloor - uw verbinding heeft met waterstof voor de berekening. Als uw verbinding bijvoorbeeld C6H6N3OCl is, schrijft u deze opnieuw als C6H7N3O.
Negeer eventuele zuurstofstoffen die uw verbinding bevat - deze zijn niet relevant voor de mate van onverzadigingsberekening. U zou nu de voorbeeldverbinding schrijven als C6H7N3.
Trek elke stikstof af van een waterstof. In dit voorbeeld kunt u de verbinding nu voorstellen als C6H4.
Bereken het onverzadigingsnummer voor uw verbinding, die nu de vorm CnHm heeft, met deze formule Ω = n - (m / 2) + 1, waarbij "Ω" de mate van onverzadiging is - het aantal pi-bindingen dat uw verbinding heeft . Voor de voorbeeldverbinding, C6H4, doet u dit als volgt: Ω = 6 - (4/2) + 1 = 6 - 2 + 1 = 5. De verbinding C6H6N3OCl bevat daarom vijf dubbele bindingen.