Wanneer u een chemie- of natuurkundeprobleem heeft waarbij u wordt gevraagd de eindtemperatuur van een stof te berekenen, bijvoorbeeld wanneer u een bepaalde hoeveelheid warmte op water aanbrengt bij een bepaalde begintemperatuur, kunt u het antwoord vinden met behulp van een van de meest voorkomende thermodynamica vergelijkingen. De grenzen tussen chemie en fysica overschrijden, thermodynamica is een tak van de fysische wetenschap die zich bezighoudt met overdracht van warmte en energie in de natuur en het universum als geheel.
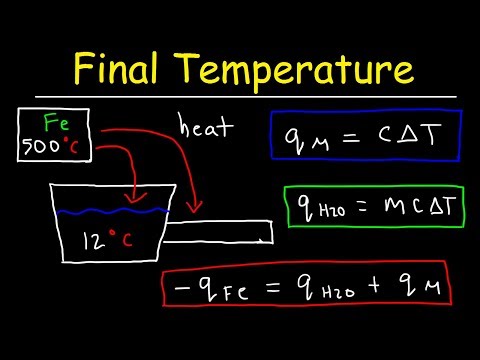
Herschrijf de soortelijke warmte-vergelijking, Q = mcΔT. De letter "Q" is de warmte die wordt overgedragen in een uitwisseling in calorieën, "m" is de massa van de stof die wordt verhit in grammen, "c" is de specifieke warmtecapaciteit en de statische waarde en "ΔT" is de verandering in temperatuur in graden Celsius om de temperatuurverandering weer te geven. Gebruik de rekenkundige wetten en deel beide zijden van de vergelijking door "mc" als volgt: Q / mc = mcΔT / mc, of Q / mc = ΔT.
Steek de waarden die je chemieprobleem je geeft in de vergelijking. Als het je bijvoorbeeld vertelt dat iemand 150 calorieën warmte toepast op 25,0 gram water, waarvan de specifieke warmtecapaciteit, of de hoeveelheid warmte die het kan weerstaan zonder een temperatuurverandering te ervaren, 1,0 calorieën per gram per graad Celsius is, vul uw vergelijking als volgt in: ΔT = Q / mc = 150 / (25) (1) = 150/25 = 6. Daarom stijgt uw watertemperatuur 6 graden Celsius.
Voeg de temperatuurverandering toe aan de oorspronkelijke temperatuur van uw stof om de uiteindelijke warmte te vinden. Als uw water bijvoorbeeld aanvankelijk 24 graden Celsius was, zou de uiteindelijke temperatuur zijn: 24 + 6 of 30 graden Celsius.