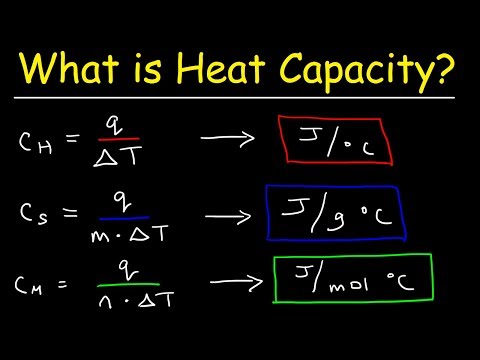
De molaire warmtecapaciteit van een stof is de hoeveelheid energie die nodig is om één mol van de stof met één graad te verhogen. De standaardeenheid is joules per mol K. Een periodiek systeem geeft typisch de specifieke warmtecapaciteit van een element weer. Specifieke warmte verschilt van molaire warmtecapaciteit doordat het wordt gemeten per gram in plaats van per mol. Afhankelijk van de informatie die u hebt en de stof in kwestie, kan het berekenen van de molaire warmtecapaciteit van een stof een eenvoudige conversie of een meer betrokken berekening zijn.
Bepaal de soortelijke warmte van de stof. Als de stof uit één element bestaat, wordt de soortelijke warmte in veel periodieke tabellen vermeld. De soortelijke warmte van zilver is bijvoorbeeld ongeveer 0,23 J / g * K. Als de stof een samenstelling van meerdere elementen is, moet u de specifieke warmte ervan experimenteel of uit een reeds bestaand document verifiëren (zie bronnen voor een tabel met algemene specifieke hitte).
Bereken de molaire massa van de stof. Het periodiek systeem geeft de molmassa van elk element weer. Als het een verbinding is, moet de molaire massa worden berekend via verhoudingen. Eén mol water omvat bijvoorbeeld 2 delen waterstof en 1 delen zuurstof. De molaire massa water wordt verkregen door elk van deze delen te vermenigvuldigen met de overeenkomstige massa's van de elementen:
2 x (1 g / mol waterstof) + (16 g / mol zuurstof) = 18 g / mol water
Vermenigvuldig de soortelijke warmte van de stof met de molaire massa van de stof. Dit resulteert in de molaire warmtecapaciteit van de stof, in joules per mol K. Voor water wordt de soortelijke warmte bijvoorbeeld gegeven als ruwweg 4.184 J / (g * K). Vermenigvuldig dit met de molaire massa:
4.184 x 18 = 75.312 J / (mol * K)