Inhoud
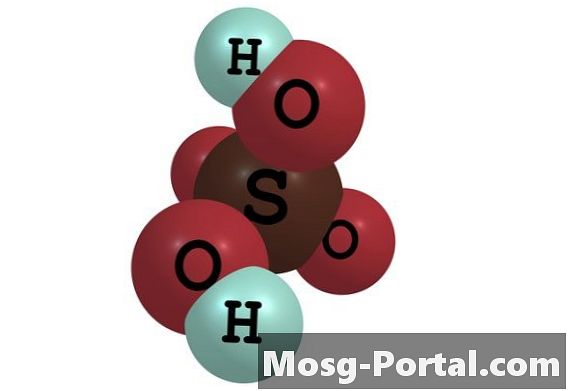
Zwavelzuur is een sterk anorganisch zuur dat vaak wordt gebruikt in de industriële productie van chemicaliën, in onderzoek en in het laboratorium. Het heeft de moleculaire formule H2SO4. Het is in alle concentraties oplosbaar in water om een zwavelzuuroplossing te vormen. In de oplossing scheidt een mol zwavelzuur zich af in een mol negatief geladen sulfaationen of SO4 (2-) en 2 mol positief geladen hydroniumionen of H30 +. De concentratie van deze ionen wordt uitgedrukt in molariteit, die wordt gedefinieerd als het aantal mol ionen per liter oplossing. Hun concentratie hangt af van de initiële concentratie van zwavelzuur.